Proteínas
• Proteínas
• Aminoácidos esenciales y no esenciales
• Calidad de la proteína
• Proteínas
Todos los tejidos vivos contienen proteínas. Se distinguen químicamente de los lípidos y de los hidratos de carbono por contener nitrógeno.
Son polímeros de aminoácidos (hay 20 distintos) unidos por enlaces peptídicos. Una proteína puede contener varios cientos o miles de aminoácidos y la disposición o secuencia de estos aminoácidos determina la estructura y la función de las diferentes proteínas. Algunas son estructurales (como el colágeno del tejido conectivo o la queratina que se encuentra en pelo y uñas), otras son enzimas, hormonas, etc.
De los 20 aminoácidos que se combinan para formar las proteínas, algunos pueden ser sintetizados por el organismo, por lo que se denominan no esenciales (alanina, arginina, ácido aspártico, asparragina, cisteína, ácido glutámico, glutamina, glicina, prolina, serina y tirosina).
Hay otros, los denominados aminoácidos esenciales o indispensables que, sin embargo, no pueden ser sintetizados por el hombre por lo que tienen que ser aportados por los alimentos, por la dieta, condicionando su esencialidad. Estos son: histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina.
La arginina puede ser esencial para los niños muy pequeños ya que sus requerimientos son mayores que su capacidad para sintetizar este aminoácido. Hay también dos aminoácidos no esenciales que se forman a partir de otros esenciales: cisteína (y cistina) a partir de metionina y tirosina a partir de fenilalanina.
Si la dieta no aporta suficiente cantidad de fenilalanina o si el organismo no puede transformar la fenilalanina en tirosina por algún motivo como sucede en la enfermedad hereditaria denominada fenilcetonuria, entonces la tirosina se convierte en esencial.
Calidad de la Proteína
Para juzgar la utilidad de las proteínas de los alimentos para mantener y reparar los tejidos y para llevar a cabo los procesos de crecimiento y formación de estructuras corporales se utiliza el término de «calidad de la proteína», calidad que se estima utilizando diversas medidas experimentales.
Durante la síntesis proteica deben estar presentes en las células todos los aminoácidos necesarios, si falta alguno, la síntesis puede fallar. Por ello, si la proteína ingerida contiene todos los aminoácidos esenciales en las proporciones necesarias para el hombre, se dice que es de alto valor biológico, que es completamente utilizable. Por el contrario, si sólo tiene pequeñas cantidades de uno de ellos (el denominado aminoácido limitante), será de menor calidad.
En general, las proteínas de los alimentos de origen animal tienen mayor valor biológico que las de procedencia vegetal porque su composición en aminoácidos es más parecida a las proteínas corporales. Las proteínas de los huevos y de la leche humana tienen un valor biológico entre 0.9 y 1 (eficacia del 90‐100%, por lo que se usan como proteínas de referencia, un concepto teórico para designar a la «proteína perfecta»); el VB de la proteína de carnes y pescados es de 0.75 y 0.8; en la proteína del trigo de 0.5 y en la de la gelatina de 0.
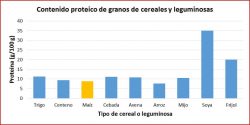
Las principales fuentes de proteína son: lácteos, carnes, pescados, huevos, cereales, leguminosas y frutos secos. En España, las carnes, los cereales y los lácteos son los alimentos que aportan mayor cantidad.
Vea nuestro máster en Dietética y Nutrición,
Estructura de las Proteínas
Las proteínas están formadas por aminoácidos, que son unidades básicas de las proteínas. Existen 20 aminoácidos diferentes, de los cuales 9 son esenciales (el cuerpo no puede sintetizarlos y debe obtenerlos a través de la dieta), mientras que los otros 11 son no esenciales (el cuerpo puede producirlos).
- Estructura primaria: La secuencia de aminoácidos que forma la proteína.
- Estructura secundaria: La disposición en hélice o lámina plegada de la cadena polipeptídica.
- Estructura terciaria: La forma tridimensional de la proteína.
- Estructura cuaternaria: La interacción entre varias cadenas polipeptídicas (en proteínas que están formadas por más de una cadena).
Funciones de las Proteínas
- Función estructural:
- Las proteínas proporcionan soporte y estructura a las células y tejidos. Por ejemplo, la queratina forma parte del cabello y las uñas, mientras que el colágeno es el principal componente de la piel, huesos y cartílago.
- Función enzimática:
- Muchas proteínas actúan como enzimas, catalizadores que aceleran las reacciones bioquímicas en el cuerpo. Sin las enzimas, las reacciones metabólicas esenciales serían demasiado lentas para mantener la vida.
- Función de transporte:
- Algunas proteínas son responsables de transportar moléculas a través del cuerpo, como la hemoglobina, que transporta oxígeno en la sangre.
- Función de defensa:
- Las proteínas del sistema inmunológico, como los anticuerpos, ayudan a defender al cuerpo contra infecciones y enfermedades.
- Función hormonal:
- Las hormonas proteicas como la insulina y la glucagón regulan diversas funciones fisiológicas, incluyendo el metabolismo y el equilibrio de glucosa en la sangre.
- Función contráctil:
- Las proteínas actina y miosina son fundamentales para la contracción muscular y el movimiento.
- Función de almacenamiento:
- Algunas proteínas, como la ferritina, almacenan hierro para ser utilizado por el cuerpo cuando sea necesario.
- Función de comunicación celular:
- Las proteínas receptores permiten que las células reciban señales de su entorno y respondan a ellas adecuadamente.
Clasificación de las Proteínas
Las proteínas pueden clasificarse de diversas maneras, dependiendo de su composición, estructura y función:
- Proteínas Simples:
- Estas proteínas están formadas solo por aminoácidos. Ejemplos incluyen la albúmina y la globulina, que se encuentran en la sangre.
- Proteínas Complejas:
- Están formadas por aminoácidos y otros componentes no proteicos, llamados grupos prostéticos. Un ejemplo es la hemoglobina, que tiene un grupo hemo que contiene hierro.
- Proteínas Fibrosas:
- Estas proteínas tienen una estructura alargada y son insolubles en agua. Son esenciales para la estructura del cuerpo. Ejemplos incluyen el colágeno (en los tejidos conectivos) y la queratina (en piel, cabello y uñas).
- Proteínas Globulares:
- Son más compactas y solubles en agua. Desempeñan funciones más específicas, como el transporte y las reacciones enzimáticas. Ejemplos incluyen la hemoglobina y las enzimas.
- Proteínas de Membrana:
- Son componentes clave de las membranas celulares y están involucradas en el transporte de moléculas a través de las células. Ejemplos incluyen transportadores y receptores celulares.
Fuentes de Proteínas
Las proteínas se pueden obtener de diversas fuentes alimenticias, que se dividen en proteínas de origen animal y proteínas de origen vegetal.
- Proteínas de origen animal:
- Son proteínas de alta calidad, ya que contienen todos los aminoácidos esenciales en las proporciones adecuadas.
- Fuentes: carne, pescado, huevo, lácteos.
- Las proteínas animales también contienen una cantidad significativa de nutrientes esenciales como hierro, vitamina B12 y ácidos grasos omega-3.
- Proteínas de origen vegetal:
- A menudo son incompletas, ya que carecen de uno o más aminoácidos esenciales. Sin embargo, una dieta bien planificada que combine diferentes fuentes vegetales (por ejemplo, legumbres con cereales) puede cubrir todas las necesidades de aminoácidos esenciales.
- Fuentes: legumbres (lentejas, garbanzos, frijoles), frutos secos, semillas, tofu, tempeh y cereales (arroz, avena, quinoa).
Requerimientos Proteicos
La cantidad de proteínas que una persona necesita depende de factores como la edad, el sexo, la actividad física, el estado de salud y la condición física.
- Requerimientos generales:
- Adultos: Aproximadamente 0.8 gramos de proteína por kilogramo de peso corporal al día.
- Atletas o personas que realizan actividad física intensa: Se recomienda 1.2 a 2.0 gramos de proteína por kilogramo de peso corporal al día, dependiendo de la intensidad del ejercicio.
- Niños, adolescentes, mujeres embarazadas y personas mayores pueden tener necesidades proteicas aumentadas.
Digestión y Absorción de las Proteínas
- Digestión en el Estómago:
- La digestión de las proteínas comienza en el estómago, donde el ácido clorhídrico desnaturaliza las proteínas, lo que facilita la acción de la pepsina, una enzima que descompone las proteínas en péptidos más pequeños.
- Digestión en el Intestino Delgado:
- En el intestino delgado, las proteínas se descomponen aún más por acción de las enzimas pancreáticas(como la tripsina) y las enzimas intestinales. Estas enzimas dividen las proteínas en aminoácidos individuales, que son absorbidos por las células intestinales y luego transportados a la sangre.
Deficiencia y Exceso de Proteínas
- Deficiencia de Proteínas:
- La deficiencia de proteínas puede llevar a trastornos como la kwashiorkor (hinchazón abdominal, retraso en el crecimiento, y debilidad) y la marasmo (desnutrición severa, pérdida de peso extrema y debilidad muscular).
- Exceso de Proteínas:
- El consumo excesivo de proteínas puede sobrecargar los riñones, especialmente en personas con problemas renales preexistentes. Además, puede llevar a un desequilibrio nutricional si se consumen en exceso sin la cantidad adecuada de otros nutrientes.